Charbon actif pour l'élimination du fer
L'industrialisation favorise le développement économique et social, mais la croissance des installations industrielles intensifie les émissions de polluants, ce qui affecte l'ensemble de l'écosystème. La pollution de l'eau est l'un des effets pénibles de l'industrialisation.
Les données montrent que près de 60% d'eau de surface et 50% d'eau potable contiennent des ions de fer. En raison des activités minières, des stations d'épuration et d'autres activités, la teneur en fer des sources d'eau a considérablement augmenté dans certaines régions. Une accumulation excessive de fer peut entraîner de graves problèmes de santé.
Dans cette étude, la technologie d'adsorption sur charbon actif a été utilisée pour traiter le fer dans l'eau. Au cours de l'expérience, la faisabilité de l'élimination des ions de fer par adsorption en discontinu et en lit fixe a été étudiée.
Introduction du fer
Le 26e élément du tableau périodique, le fer, est un élément important. Il recouvre environ 5% de la croûte terrestre et est le deuxième métal le plus abondant, après l'oxygène, le silicium et l'aluminium parmi les éléments.
Le fer élémentaire est un métal de transition. Les états d'oxydation de base sont +2 (ferreux) et +3 (ferrique), bien qu'il existe également des états d'oxydation +4 (ferreux) et +6 (ferrate). Les composés de fer à l'état +2 sont appelés ferreux et se composent d'ions Fe vert clair, tandis que les composés de fer à l'état +3 sont appelés ferriques et contiennent des ions complexes Fe, qui passent du jaune à l'orange et finalement au brun, en fonction du degré d'hydrolyse.
Dans l'eau oxygénée, les ions Fe2+ sont oxydés en ions Fe3+. La vitesse d'oxydation dépend principalement de la concentration en ions H+ et de la température de la solution. Les ions ferreux retiennent généralement une plus grande quantité de fer en solution que les ions ferriques, et les éléments ferreux ont tendance à être plus solubles que le fer élémentaire.
Adsorption pour l'élimination du fer
Le fer est hautement toxique et il est donc nécessaire de contrôler ce polluant au niveau des émissions. Il existe de nombreuses technologies pour éliminer le fer de l'eau potable et des déchets municipaux, telles que l'échange d'ions et l'adoucissement de l'eau, l'extraction par fluide supercritique, l'oxydation aérée, la microfiltration/ultrafiltration, les filtres à particules aérés et la biorestauration.
Le principal inconvénient de ces technologies est qu'elles sont soit coûteuses, soit impossibles à utiliser sans électricité. L'adsorption est l'adhésion d'une substance adsorbée (adsorbat) à une surface solide. Les adsorbats existent en phase fluide sous forme de solutés dissous dans des liquides ou des gaz. L'adsorption est préférée à d'autres traitements en raison de sa facilité d'utilisation, de sa conception simple, de sa capacité élevée, de son faible coût, de sa faible production de sous-produits et de sa grande efficacité thérapeutique.
Il s'agit d'un phénomène de surface qui exige que les polluants présents dans les eaux usées s'accumulent à la surface de l'adsorbant. Ce dépôt d'ions métalliques sur l'adsorbant se produit à l'interface de l'adsorbant, ce qui donne lieu à une structure bidimensionnelle. Cette structure dépend des propriétés de l'adsorbant, telles que la charge de surface, la surface et la fonctionnalité de la surface.
L'adsorption est également supérieure aux autres procédés d'élimination en raison de sa grande efficacité et de la possibilité de régénérer l'adsorbant et de récupérer l'adsorbat. L'adsorption du fer par divers adsorbants est l'un des moyens de surmonter ces difficultés. En raison de son comportement multifonctionnel, le charbon actif a été identifié comme étant très actif dans le traitement des eaux usées.
Structure du carbone activé
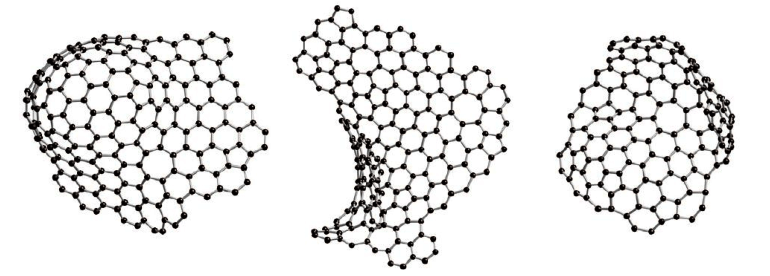
La configuration atomique exacte du charbon actif est inconnue, malgré son importance commerciale dans la purification de l'eau et de l'air. La configuration du carbone est préparée par pyrolyse. Ces carbones peuvent être classés en deux groupes distincts, graphitisés et non graphitisés. Le carbone dérivé du charbon actif est non graphitisé, ce qui signifie qu'il peut se transformer en graphite cristallin même à des températures très élevées (≥3000℃).
Les études de diffraction des neutrons ont montré que les carbones non graphitisables ont une structure similaire à celle des fullerènes, comme le montre la figure 1. Mais il n'a pas été possible de prouver clairement que les atomes sont liés sous la forme d'anneaux pentagonaux ou hexagonaux.
Pores de carbone activé
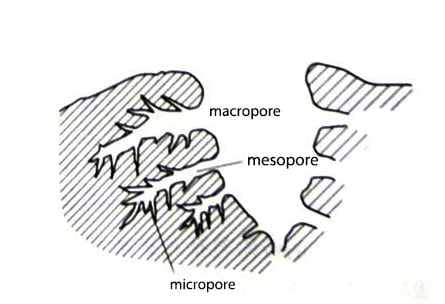
Outre la cristallisation et la configuration chimique du charbon actif, sa structure poreuse joue également un rôle crucial dans diverses applications. La capacité d'absorption du charbon actif est fortement liée à la surface, au volume des pores et à la distribution de la taille des pores.
Il dépend principalement de la nature et du traitement chimique des matières premières. La structure poreuse du charbon actif est produite par l'élimination des substances non carbonées dans la matière première au cours de la carbonisation, ce qui produit un bloc de carbone fixe avec une structure poreuse de base, qui se développe ensuite au cours du processus d'activation.
Le processus d'activation élargit le diamètre des pores créés lors de la carbonisation et crée en même temps de nouveaux pores, ce qui donne une structure poreuse bien développée. Les pores du charbon actif sont répartis en différentes tailles et formes. La distribution de la taille des pores du charbon actif obtenu est principalement affectée par le degré d'imprégnation. Les conditions d'activation et de carbonisation sont les paramètres les plus critiques affectant le type de porosité du charbon actif obtenu.
Les charbons actifs sont classés par taille de pore comme suit : macropores (>50nm), mésopores (2-5nm) et micropores (<2nm). Les micropores peuvent être subdivisés en ultramicropores (<0,5 nm) et en ultramicropores (1-2 nm). Les mésopores servent de voies de passage pour les molécules d'adsorbat à travers le réseau microporeux. Les macropores n'ont aucune utilité, mais ils aident à guider les ions métalliques dans les mésopores et les surfaces microporeuses. La distribution caractéristique de la taille des pores du charbon actif est illustrée à la figure 2.
Conditions de fonctionnement du charbon actif pour le fer
Le processus d'adsorption dépend largement de diverses contraintes telles que le pH, le dosage du sorbant, la concentration initiale, le temps de contact et la température. L'effet de ces paramètres sur l'adsorption du fer par le charbon actif a été étudié en détail afin de déterminer les conditions optimales.
Le charbon actif a été utilisé pour exclure les ions Fe(II) de la phase aqueuse dans plusieurs gammes de pH allant de 2 à 6. On a constaté qu'à pH<3, l'efficacité d'élimination était la plus faible. À mesure que la valeur du pH de la solution augmente, le pourcentage d'élimination augmente de manière significative, et le taux d'élimination maximal est atteint à pH5,0.
La quantité de fer adsorbé sur le charbon actif augmente avec le temps de contact. En raison de la force motrice élevée entre l'adsorbant et les ions métalliques en solution, la vitesse d'adsorption est rapide au cours des 90 premières minutes.
Les sites d'adsorption sont accessibles au début, ralentissent et atteignent l'équilibre vers 150 min. L'extension du temps de fonctionnement à 6 h n'a pas eu d'effet sur la concentration résiduelle des ions métalliques, ce qui indique que l'équilibre a été atteint à 150 min, après quoi l'accumulation des ions ferreux rend difficile leur diffusion dans le sorbant. La résistance à la diffusion augmente avec l'amélioration du remplissage des micropores, ce qui contredit l'effet du temps de contact.
L'élimination des ions métalliques est un processus qui dépend fortement de la concentration et qui peut être considéré comme un effet du transport de masse. L'adsorption est régulée par la couverture monocouche des molécules sur les limites du charbon actif.
Par conséquent, le processus d'adsorption est initialement très rapide. À des concentrations plus élevées, les vides présents à la surface du carbone seront entourés d'un plus grand nombre d'adsorbants. Par conséquent, les ions métalliques n'ont pas seulement été adsorbés par la monocouche sur la surface périphérique de l'adsorbant de charbon actif, mais ont également diffusé à l'intérieur des particules de charbon actif.
Conclusion
Le charbon actif adsorbe pour éliminer l'impact du fer sur l'environnement. Bien que le fer soit un minéral important pour l'homme, si la teneur en fer de l'eau dépasse un certain niveau, l'eau devient impropre à la consommation, ce qui entraîne divers troubles de la santé. L'approvisionnement en eau potable est un besoin humain universel. C'est pourquoi il est essentiel de disposer de technologies efficaces et abordables pour utiliser le charbon actif dans le traitement de l'eau afin d'éliminer le fer de l'eau et de garantir la salubrité de l'eau potable.